2017年3月31日,日本厚生省在国立药品食品卫生研究所主页发布《医疗用药品最新质量信息集》,简称蓝皮书(Blue book)。该蓝皮书包括4种有效成分、76个品种的仿制药信息。
什么是蓝皮书
蓝皮书是日本《医疗用药品最新质量信息集》的简称。其发布的信息以日本仿制药质量信息研讨会的检验结果为基础,汇集了各有效成分质量的相关信息,目的在于提供给医药工作者,以进一步提升仿制药质量的可信赖性。
发布蓝皮书的背景
溶出度试验是评价口服固体制剂内在质量的一种重要手段,旨在保证不同生产企业生产的同一药品的口服固体制剂具有相同的品质和疗效。
日本自1998年开展了“药品品质再评价工程”,即通过全面、细致、严格的体外溶出度试验对药品的内在品质进行评估。此后,日本厚生省药品管理机构每年出版一期《医疗用药品品质情报集》(即日本参比制剂目录)简称橙皮书(Orange Book),详细收载口服固体制剂的溶出度研究与评价信息(如:不同溶出介质下的标准溶出曲线信息)。
2015年6月,日本内阁会议通过的“经济财政运营及改革基本方针2015”中,提出了“2017年,将仿制药的市场占有率提高至70%以上,力争在2018年至2020年年末内提高至80%以上”的新目标。
2015年9月,厚生劳动省制定了“医药产业强化综合战略”,对加快推进仿制药的使用出台了各项措施,包括质量保证对策、信息提供、普及、启发等,并商讨发布《医疗用药品最新质量信息集》(蓝皮书)。
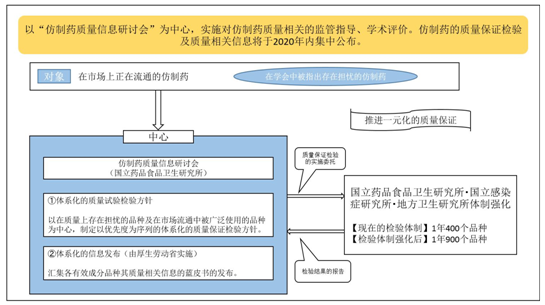
自2016年,为进一步提高仿制药质量的可信赖性,以“仿制药质量信息研讨会”(由相关专家组成的专门组织)为中心,促进仿制药质量相关的学术评价、监管指导相互联动,推进一元化的质量保证机制。
仿制药质量信息研讨会重点针对在质量上存在担忧的品种及在市场流通中被广泛使用的品种,制定以优先度为序列的的质量检验方针,由国立药品食品卫生研究所、国立感染症研究所及地方研究所实施质量检验。在其检验结果的基础上,汇总各有效成分的质量检验及质量相关信息,编辑成资料集(蓝皮书)。仿制药质量信息研讨会专门设立工作小组,负责蓝皮书的编辑、校阅、研究、对外发布工作。(参见下图)
蓝皮书的内容
在蓝皮书中,记载了以下15项内容的最新信息:
⑴有效成分;⑵品种名称;⑶适应症/用法用量;④添加剂;⑸离解常数;⑹溶解度;⑺稳定性;⑻膜透过性;⑼BCS・Biowaiver option;⑽药效分类;⑾规格单位;⑿生物等效性试验结果;⒀溶出试验结果;⒁仿制药质量检验结果;⒂分析法。
蓝皮书与橙皮书的区别
日本的橙皮书,全称为《医疗用药质量量信息集》,是汇集药品质量再评价结果、制剂溶出性及相关质量信息的刊物,每年约发行4期。而蓝皮书则配合其仿制药的集中质量检测工作,集中分批发布,预计2020年为发布高峰。

 010-64929757
010-64929757  service@gcpunion.org
service@gcpunion.org  北京市北三环中路朝阳区安外小关北里43号渔阳置业大厦A座706
北京市北三环中路朝阳区安外小关北里43号渔阳置业大厦A座706 
