摘要
目的
探讨二甲双胍对阿霉素耐药的甲状腺未分化癌HTh74Rdox细胞生长的影响及其分子机制。
方法
二甲双胍作用于HTh74Rdox 48 h后,以光学显微镜观察细胞形态变化,四甲基偶氮唑盐(MTT)法检测细胞活力,以锚定蛋白Ⅴ-碘化丙啶双染的流式细胞术检测细胞凋亡情况,以实时荧光定量聚合酶链式反应(RT-PCR)检测抑癌microRNA的表达水平,以Western印迹检测一磷酸腺苷活化的蛋白激酶(AMPK)及哺乳动物雷帕霉素靶蛋白(mTOR)的表达水平;HTh74Rdox细胞转染miRNA inhibitors 24 h,继以二甲双胍干预48 h后,以流式细胞术检测细胞凋亡率,以Western印迹检测AMPK和mTOR的蛋白表达水平。
结果
二甲双胍可呈剂量依赖性地抑制HTh74Rdox的细胞活力、促进细胞凋亡,并上调miR-34a、miR-101、miR-125b及miR-138的表达,同时上调磷酸化(p-)AMPK、抑制p-mTOR的表达;以miR-inhibitors共转阻断miR-34a、miR-101、miR-125b、miR-138的表达后,可逆转二甲双胍对HTh74Rdox细胞的促凋亡效应以及对AMPK/mTOR通路蛋白的激活效应。
结论
二甲双胍通过上调阿霉素耐药的人甲状腺未分化癌HTh74Rdox细胞中抑癌基因miR-34a、miR-101、miR-125b、miR-138的表达,激活能量代谢信号通路AMPK/mTOR,发挥抑制肿瘤细胞生长、促进肿瘤细胞凋亡的作用。
甲状腺肿瘤是内分泌系统最常见的肿瘤,其中,甲状腺未分化癌恶性程度最高,侵袭性最强,预后最差。此类型肿瘤患者虽临床相对少见,但往往就诊时已是进展期甚至晚期,常伴远处转移,且对传统治疗药物阿霉素和放射治疗均不敏感,仍是目前临床治疗的难题。二甲双胍是2型糖尿病患者临床治疗的一线用药。近年有研究证实,二甲双胍可降低2型糖尿病患者肿瘤发病风险及肿瘤相关死亡风险[1,2,3,4]。本研究前期研究证实,二甲双胍可以抑制阿霉素耐药的人甲状腺未分化癌细胞HTh74Rdox的自我更新能力,对甲状腺未分化癌细胞具有靶向杀伤作用[5]。
值得指出的是,近年微小RNAs(microRNAs, miRNAs)在各种肿瘤组织中表达水平的异常越来越受到人们关注。miRNAs是真核生物中发现的一类具有调控功能的短序非编码RNA,具有调节肿瘤生长的潜能。研究报道,miRNA let-7、miRNA 26a、miRNA 200等抑癌miRNAs在恶性肿瘤中表达下降,可能参与调控上皮间质转移(epithelial-mesenchymal transition, EMT)以及维持肿瘤干细胞特性[6,7,8]。另有研究报道,在宫颈癌中,miR-34a、miR-101调节障碍可在细胞周期水平促进肿瘤细胞分裂、抑制肿瘤细胞侵袭和增殖[9,10]。miRNA125b被报道可通过作用于鞘氨醇激酶1进而抑制膀胱癌细胞的增殖和转移[11]。miRNA138可通过作用于果蝇zeste基因增强子同源物2来抑制骨肉瘤生长并促进肿瘤细胞凋亡[12]。
二甲双胍抑制阿霉素耐药的人甲状腺未分化癌HTh74Rdox细胞的生长,是否与以上抑癌miRNA调节甲状腺肿瘤细胞生长有关?本研究针对以上抑癌miRNAs,探讨二甲双胍抑制甲状腺未分化癌细胞增殖生长的分子机制。
材料和方法
一、材料
1.细胞株:
人甲状腺未分化癌阿霉素耐药株HTh74Rdox由德国Charite医学院Derwahl教授赠送。
2.药物:
二甲双胍购于美国Sigma公司,用磷酸缓冲盐溶液溶解配置成1 mol/L储存液,-20℃冰箱储存。
3.试剂:
F12培养基购于美国Gibco公司,胎牛血清、青霉素和链霉素购于美国Invitrogen公司。一抗β-actin购自美国Santa Cruz公司,一抗一磷酸腺苷活化的蛋白激酶(AMPK)、磷酸化(p-)AMPK、哺乳动物雷帕霉素靶蛋白(mTOR)、p-mOTR及羊抗鼠-辣根过氧化物酶标记二抗、羊抗兔-辣根过氧化物酶标记二抗购自美国cell signaling technology公司。miRNA引物、miRNA转染试剂盒以及miR-34a inhibitor、miR-101 inhibitor、miR-125b inhibitor、miR-138 inhibitor均购自广东锐博公司。
二、方法
1.细胞培养条件:
阿霉素耐药的甲状腺未分化癌HTh74Rdox细胞置于37℃、5% CO2的培养箱中,用含100 μg/ml链霉素、100 U/ml青霉素和10%胎牛血清的F-12培养液进行培养。
2.细胞形态观察:
以不同浓度二甲双胍(0、5、10 mmol/L)作用于HTh74Rdox细胞,加药48 h后使用莱卡倒置显微镜(200×)拍摄细胞形态。
3.细胞活力检测:
四甲基偶氮唑盐(MTT)法检测二甲双胍对HTh74Rdox细胞活力的影响。将HTh74Rdox细胞接种于96孔板中,密度为5×103个/孔,每组设6个复孔;培养24 h后,加入含不同浓度二甲双胍(0、2.5、5、10、20、40、80 mmol/L)的培养液,继续培养48 h后,每孔加MTT 10 μl(5 mg/ml),37℃培养箱孵育4 h后去上清,每孔加二甲基亚砜(DMSO)100 μl,溶解结晶10 min(室温轻微震荡)后检测570 nm波长处的吸光度(A)值,计算细胞活力。细胞活力=实验组A值/对照组A值×100%。
4.锚定蛋白Ⅴ-碘化丙啶双染流式细胞术检测细胞凋亡:
将实验处理过的HTh74Rdox细胞,以胰酶消化悬浮,收集离心,然后用预冷的磷酸缓冲盐溶液冲洗并1 000转/min离心2次,每次5 min。后用稀释好的缓冲试剂悬浮细胞,取出部分细胞混悬液,各加1∶1的锚定蛋白Ⅴ和碘化丙啶,室温避光放置15 min,再各加400 μl缓冲试剂,上机检测。
5.RNA提取和实时荧光定量聚合酶链式反应(RT-PCR):
消化HTh74Rdox细胞,用Trizol法提取总RNA,继以ReverTra Ace® RT-PCR RT kit(Code No:FSQ-101)进行逆转录,逆转录条件为:37℃,15 min;98℃,5 min。RT-PCR实验使用Roche Light CyclerTM的SYBR Green掺入法,体系为20 μl,95℃预变性,20 s;95℃变性,10 s;60℃退火,20 s;70℃延伸,10 s,共40个循环。循环结束后应用系统软件绘制扩增曲线、熔解曲线。内参使用U6,用2-ΔΔCT法计算相对表达量,ΔCT=CT(目的)-CT(内参)。所有引物均由广东锐博公司提供。
6.Western印迹蛋白检测:
将二甲双胍或转染试剂干预过的贴壁细胞,去除培养液,磷酸缓冲盐溶液洗1遍,胰酶消化后收集至1.5 ml离心管,2 000转/min离心5 min,弃上清液;磷酸缓冲盐溶液冲洗沉淀1次,再次2 000转/min离心5 min,加裂解液,置于冰上裂解30 min,然后4℃ 14 000转/min离心30 min;BCA蛋白定量法测定蛋白浓度。用10%的十二烷基硫酸钠聚丙烯酰胺凝胶进行电泳,上样量为15 μg/孔,湿转至聚偏二氟乙烯超滤膜,5%脱脂奶粉封闭2 h。一抗AMPK、p-AMPK、mTOR、p-mTOR、β-actin 4℃孵育过夜,继而磷酸缓冲盐溶液洗膜3次后,以二抗室温孵育2 h,洗膜、曝光。
7.miRNA inhibitor转染实验:
HTh74Rdox细胞贴壁培养至对数生长期,使用广东锐博公司riboFECTTMCP转染miRNA 34a、miRNA 101、miRNA 125b、miRNA 138 inhibitor,转染浓度使用该公司riboFECTTMCP转染miRNA用量参考表。
三、统计学处理
应用SPSS 20.0软件对数据进行统计学分析。符合正态分布的计量数据以 ±s表示,两样本均数比较使用t检验,多组间均数比较使用单因素方差分析,P
±s表示,两样本均数比较使用t检验,多组间均数比较使用单因素方差分析,P
结果
一、二甲双胍对HTh74Rdox细胞生长的影响
1.二甲双胍处理HTh74Rdox后细胞形态变化:
不同浓度二甲双胍(0、5、10 mmol/L)处理对数生长期的HTh74Rdox细胞48 h后,在光学显微镜下观察细胞形态,与对照组(0 mmol/L)相比,二甲双胍加药组细胞生长稀疏,形态皱缩,且脱壁现象逐渐明显,10 mmol/L二甲双胍处理时尤甚(图1)。

图1 不同浓度二甲双胍处理48 h对HTh74Rdox细胞形态的影响(×200)
Fig 1 Morphology of HTh74Rdox cell after treatment with metformin for 48 h (×200)
2.二甲双胍抑制HTh74Rdox细胞活力:
MTT实验表明,二甲双胍作用HTh74Rdox 48 h后,可呈浓度依赖性抑制HTh74Rdox细胞生长(图2)。二甲双胍对HTh74Rdox细胞的IC50是(16.76±2.53)mmol/L。
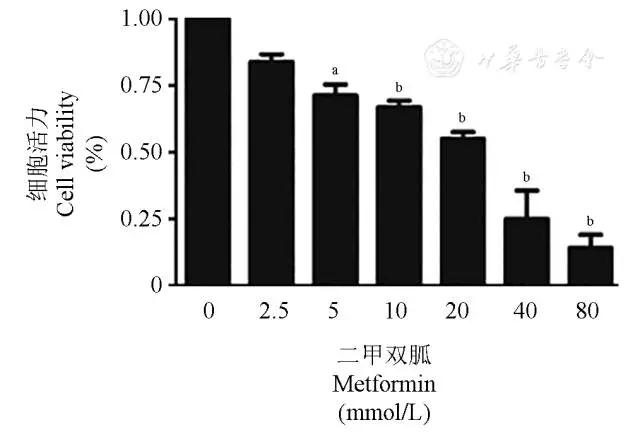
图2 二甲双胍对HTh74Rdox细胞活力的影响
Fig 2 Metformin inhibited HTh74Rdox cell viability by concentration dependently
二、二甲双胍促进HTh74Rdox细胞凋亡
将贴壁24 h的HTh74Rdox细胞,分别以不同浓度二甲双胍(0、5、10 mmol/L)干预48 h,然后以流式细胞术检测细胞凋亡情况。结果表明,二甲双胍可促进甲状腺未分化癌癌细胞凋亡,且随浓度增加凋亡增多(图3)。
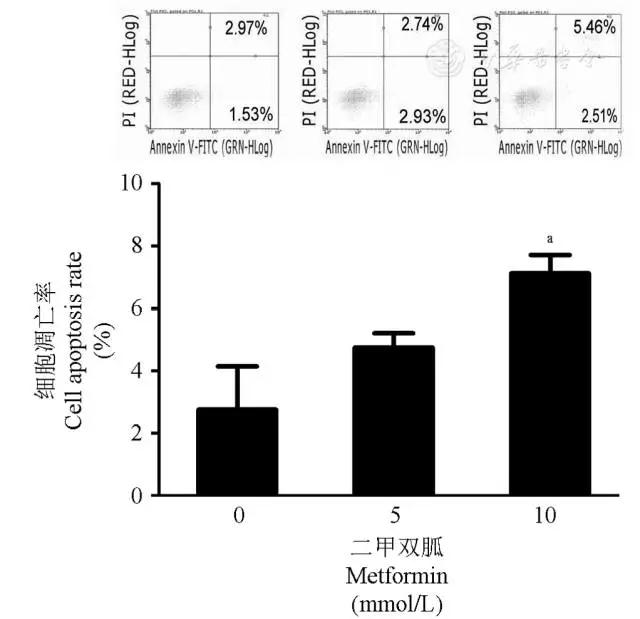
图3 二甲双胍处理48 h可促进HTh74Rdox细胞凋亡
Fig 3 The apoptosis induced by metformin in HTh74Rdox cell(48 h treatment)
三、二甲双胍提高HTh74Rdox细胞中抑癌miRNA的表达
与阿霉素敏感的HTh74相比,阿霉素耐药株HTh74Rdox中miR-34a、miR-101、miR-125b、miR-138表达水平降低(图4A)。使用二甲双胍干预细胞48 h后,可提高耐药株HTh74Rdox中miR-34a、miR-101、miR-125b、miR-138的表达水平(图4B)。
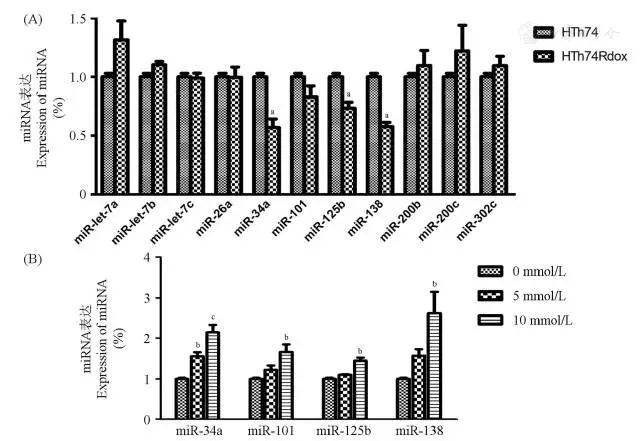
图4 二甲双胍可提高HTh74Rdox中miR-34a、miR-101、miR-125b、miR-138表达水平
Fig 4 Metformin increased the expression of miR-34a、miR-101、miR-125b、miR-138 in HT h74Rdox cell
四、二甲双胍可激活HTh74Rdox细胞中AMPK/mTOR信号通路
Western印迹结果表明,不同浓度二甲双胍(0、5、10 mmol/L)处理HTh74Rdox细胞48 h后,与对照组(0 mmol/L)相比,5 mmol/L和10 mmol/L二甲双胍处理组中AMPK/mTOR通路被激活,磷酸化AMPK蛋白表达量上升,磷酸化mTOR蛋白表达量下降(图5)。
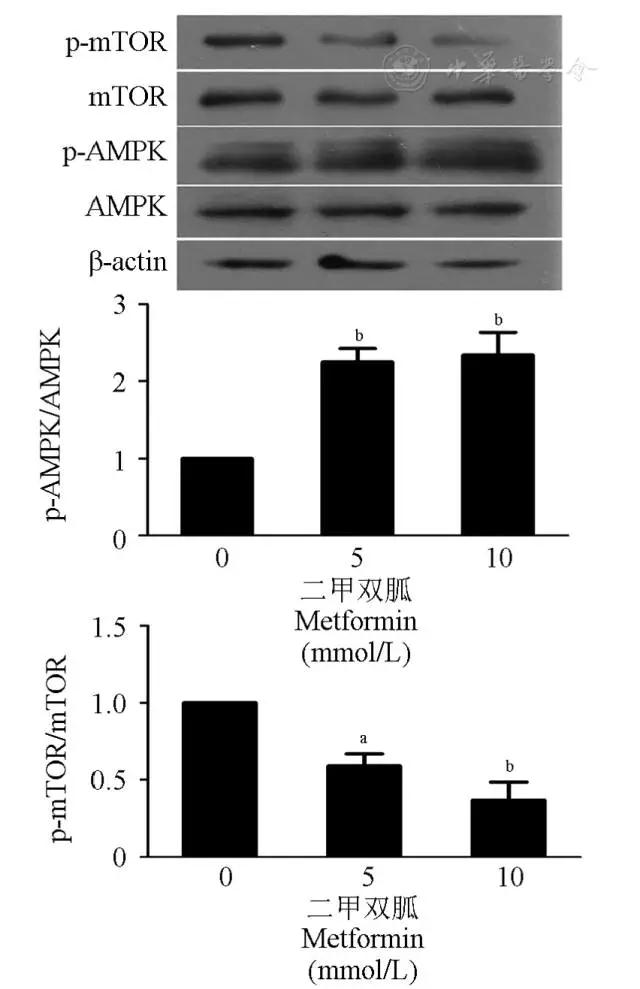
图5 不同浓度二甲双胍处理HTh74Rdox细胞48 h后,p-AMPK/AMPK、p-mTOR/mTOR蛋白表达量的变化
Fig 5 Metformin activated the AMPK/mTOR pathway in HTh74Rdox cell after 48 h treatment
五、miRNA抑制剂可逆转二甲双胍对HTh74Rdox细胞的促凋亡作用
将miR-34a inhibitor、miR-101 inhibitor、miR-125b inhibitor、miR-138 inhibitor共转入贴壁24 h的HTh74Rdox细胞,继以5 mmol/L的二甲双胍作用48 h。与对照组相比,miRNA抑制组细胞凋亡明显减少(图6)。
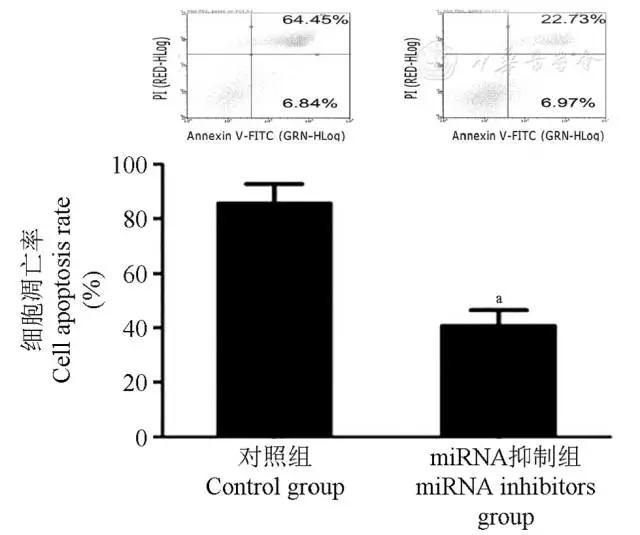
图6 miRNA抑制剂可逆转二甲双胍的促凋亡作用
Fig 6 The apoptotic effect of metformin was inhibited in HTh74Rdox cell when transfected with miR-34a、miR-101、miR-125b、miR-138 inhibitors
六、miRNA抑制剂可逆转二甲双胍对AMPK/mTOR信号通路的激活作用
以miRNA inhibitor共转染贴壁细胞HTh74Rdox 24 h,继以5 mmol/L二甲双胍处理细胞48 h后,检测AMPK/mTOR通路蛋白的表达。Western印迹结果表明,miRNA被抑制后,二甲双胍对AMPK/mTOR通路的激活作用被阻断,即p-AMPK蛋白表达降低,p-mTOR蛋白表达升高(图7)。
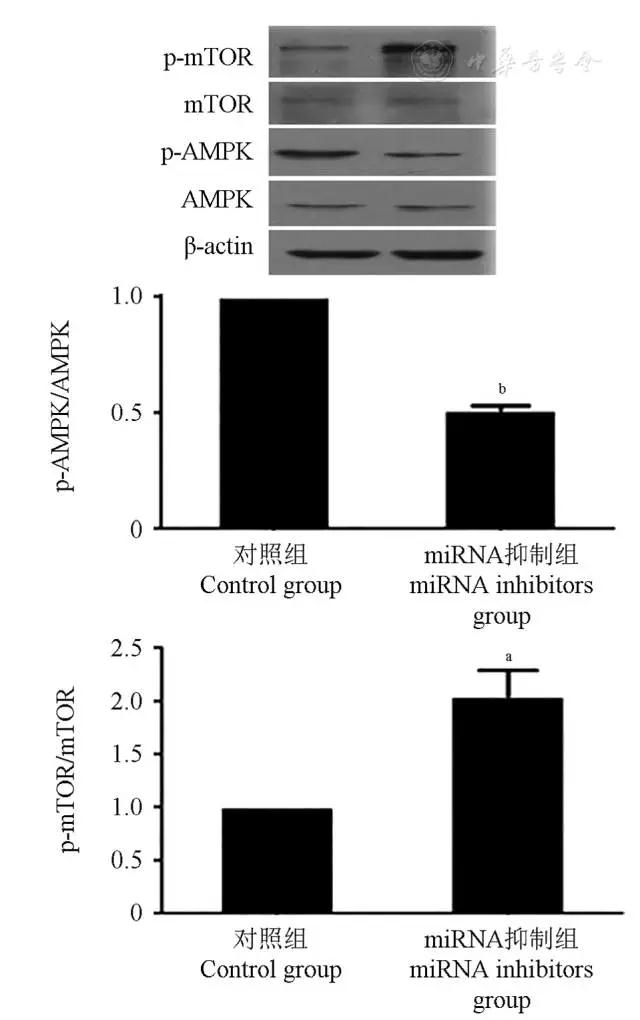
图7 miRNA抑制剂可逆转二甲双胍对AMPK/mTOR通路蛋白的激活作用
Fig 7 The stimulative effect of metformin was reversed in HTh74Rdox cell when transfected with miR-34a、miR-101、miR-125b、miR-138 inhibitors
讨论
二甲双胍是治疗2型糖尿病的一线用药。循证医学证据表明,二甲双胍可降低糖尿病患者多种肿瘤的发生率和肿瘤相关死亡率[13]。本研究组前期研究表明,二甲双胍可以抑制阿霉素耐药的甲状腺未分化癌HTh74Rdox细胞的克隆形成率以及肿瘤细胞球形成率,AMPK/mTOR通路被证明是二甲双胍作用的分子靶点[5]。
miRNAs是真核生物中发现的一类具有调控功能的短序非编码RNA,具有调节肿瘤生长的潜能。其是否在甲状腺未分化癌中异常表达?是否参与调节甲状腺未分化癌的细胞生长?目前国内外相关研究鲜有报道。
本研究发现,相较于阿霉素敏感的野生型甲状腺未分化癌HTh74细胞,阿霉素耐药株HTh74Rdox中miRNA34a、miRNA101、miRNA125b、miRNA138均表达降低,提示这四种miRNAs作为抑癌基因,其表达量的下调一定程度上赋予了该阿霉素耐药株HTh74Rdox更高的肿瘤侵袭性和生长力。本研究进一步证实,使用二甲双胍处理该阿霉素耐药株HTh74Rdox后,4种抑癌miRNAs表达量均增加,且呈剂量依赖性。然而,此前文献报道miRNA let-7、miRNA 26a、miRNA 20在恶性组织中表达下降,在本研究中并未得出相同结果,考虑是由于miRNAs家族成员较多,其表达水平在不同肿瘤组织中存在差异。
已知二甲双胍可通过多种信号通路抑制肿瘤,经典途径如MAPK蛋白及其下游通路、AMPK/mTOR通路、p53蛋白及其下游通路、IGF-1R/mTOR通路等[14]。如前所述,本研究前期研究及本研究证实二甲双胍可抑制HTh74Rdox增殖,并激活AMPK/mTOR信号通路。结合本研究中发现的二甲双胍处理后4种抑癌miRNAs表达上调,本研究推测,二甲双胍通过上调以上抑癌miRNAs,进而激活AMPK/mTOR通路,从而抑制HTh74Rdox增殖。本研究引入miRNA抑制剂(miR-34a inhibitor、miR-101 inhibitor、miR-125b inhibitor、miR-138 inhibitor),通过miRNA inhibitor共转染实验,利用Western印迹检测AMPK/mTOR通路蛋白水平,验证以上理论假设。
AMPK在细胞能量平衡中发挥重要作用,广泛存在于肝脏、脑、骨骼肌等组织。它由α、β、γ三种亚基组成,其中α为催化亚基,该亚基的磷酸化意味着AMPK的激活,继而抑制下游mTOR蛋白的表达[15,16]。mTOR其活性增高将促进细胞周期进展并促进细胞增殖,同时可促进癌细胞生长[17]。而AMPK的磷酸化将抑制下游mTOR表达,从而抑制肿瘤生长。本研究及本研究前期研究证实,二甲双胍可通过上调磷酸化AMPK水平从而下调mTOR蛋白表达,最终抑制HTh74Rdox增殖。
通过共转染实验抑制癌细胞株中miRNA34a、miRNA101、miRNA125b、miRNA138的表达后,二甲双胍原先的作用效果被逆转,AMPK/mTOR信号通路被抑制,二甲双胍对该细胞株的促凋亡效应被阻断。由此本研究推断,二甲双胍可通过提高甲状腺未分化癌HTh74Rdox细胞中miRNA34a、miRNA101、miRNA125b、miRNA138的表达,激活AMPK/mTOR信号通路而发挥抑制癌细胞增殖,促进癌细胞凋亡的作用。
值得指出的是,抑癌miRNA通过肿瘤干细胞途径从而抑制肿瘤生长日益受到人们关注。肿瘤干细胞学说认为,与一般肿瘤细胞相比,这小部分肿瘤干细胞具有自我更新、分化等干细胞特性,且对化疗和放疗不敏感,被认为是恶性肿瘤耐药、复发及转移的根源所在。miR-34a已被证明可下调肿瘤干细胞标志物,抑制多种肿瘤生长[18]。近年有研究指出,miR-34a可参与调节结肠癌肿瘤干细胞的非对称分裂,沉默miR-34a的表达将通过抑制非对称分裂而促进肿瘤干细胞增殖[19]。在恶性胶质瘤肿瘤干细胞中,miR-101被检测到表达降低,而过表达miR-101可抑制该肿瘤干细胞的增殖、侵袭及转移能力[20]。在一项多中心临床研究中,miR-125b等被证明可作为基因组探针来预测富含肿瘤干细胞的乳腺癌患者预后[21]。在乳腺癌组织中,miR-138被证明可通过下调波形蛋白、上调E-钙黏连蛋白的表达,从而抑制上皮间质化转移,最终达到抑制乳腺癌的作用[22]。
关于甲状腺肿瘤干细胞与抑癌miRNA的报道,目前鲜有耳闻。本研究中使用的HTh74Rdox细胞株,富含甲状腺肿瘤干细胞约70%[23]。二甲双胍通过提高抑癌miRNA水平所诱发的抗肿瘤效应,是否与抑制该HTh74Rdox细胞株中的肿瘤干细胞有关,尚不得而知,更深入的相关研究有待进行。
本研究在体外证明二甲双胍通过上调甲状腺未分化癌细胞株中miRNA34a、miRNA101、miRNA125b、miRNA138的表达,从而激活AMPK/mTOR信号通路,抑制癌细胞增殖,为进一步动物模型在体研究提供了分子机制及理论基础,也为临床上甲状腺未分化癌的治疗提供了新思路。本研究不足之处在于,目前研究仅局限于体外实验,进一步的动物在体实验有待进行。

 010-64929757
010-64929757  service@gcpunion.org
service@gcpunion.org  北京市北三环中路朝阳区安外小关北里43号渔阳置业大厦A座706
北京市北三环中路朝阳区安外小关北里43号渔阳置业大厦A座706 
